De MemTrax-test vergeleken met de Montreal Cognitive Assessment Schatting van milde cognitieve stoornissen
Artikeltype: MemTrax Onderzoek Artikel
Auteurs: van der Hoek, Marjanne D. | Nieuwenhuizen, Arie | Keijer, Jaap | Ashford, J. Wesson
Toetredingen: Stanford University, Stanford, CA, VS - Afdeling Psychiatrie en Gedragswetenschappen, Applied Research Centre Food and Dairy, Hogeschool Van Hall Larenstein, Leeuwarden, Nederland | Fysiologie van mens en dier, Wageningen Universiteit, Wageningen, Nederland | Studiecentrum voor oorlogsgerelateerde ziekten en verwondingen, VA Palo Alto HCS, Palo Alto, CA, VS
DOI: 10.3233/JAD-181003
Tijdschrift: Tijdschrift van De ziekte van AlzheimerVol. 67, nee. 3, pp. 1045-1054, 2019
Abstract
Cognitieve stoornissen zijn een belangrijke oorzaak van disfunctie bij ouderen. Wanneer milde cognitieve stoornis (MCI) komt voor bij ouderen en is vaak een prodromale aandoening van dementie. De Montreal Cognitive Assessment (MoCA) is een veelgebruikte tool om te screenen op MCI. Deze test vereist echter een face-to-face afname en bestaat uit een reeks vragen waarvan de antwoorden door de beoordelaar worden opgeteld om een score te verkrijgen waarvan de precieze betekenis controversieel is. Dit onderzoek is opgezet om de prestaties van een computergestuurde computer te evalueren geheugentest (MemTrax), wat een aanpassing is van een continue herkenningstaak, met betrekking tot de MoCA. Er worden twee uitkomstmaten gegenereerd uit de MemTrax-test: MemTraxspeed en MemTraxcorrect. De proefpersonen kregen de MoCA en de MemTrax-test. Op basis van de resultaten van de MoCA werden proefpersonen verdeeld in twee groepen van cognitieve status: normale cognitie (n = 45) en MCI (n = 37). De gemiddelde MemTrax-scores waren significant lager in de MCI dan in de normale cognitiegroep. Alle uitkomstvariabelen van MemTrax waren positief geassocieerd met de MoCA. Twee methoden, het gemiddelde berekenen MemTrax-score en lineaire regressie werden gebruikt om de afkapwaarden van de MemTrax-test te schatten om MCI te detecteren. Deze methoden toonden aan dat voor de uitkomst MemTraxsnelheid een score onder het bereik van 0.87 – 91 s-1 is een indicatie van MCI, en voor de uitkomst MemTraxte corrigeren een score onder het bereik van 85 – 90% is een indicatie voor MCI.
INLEIDING
De wereldbevolking, aangevoerd door Europa, Noord-Amerika en Noord-Azië, vergrijst, waardoor het aandeel ouderen snel toeneemt. Met toenemende leeftijd is er een gevestigde progressieve, exponentiële toename van de ontwikkeling van cognitieve stoornissen, dementie en Ziekte van Alzheimer (AD), wat leidt tot een enorme toename van het aantal mensen met deze aandoeningen. Vroegtijdige opsporing en identificatie van cognitieve stoornissen kan de patiëntenzorg verbeteren, de kosten van de gezondheidszorg verlagen en zou kunnen helpen bij het vertragen van het begin van ernstigere symptomen, en zo mogelijk helpen om de snel ontwikkelende last van dementie en AD te verlichten. Daarom zijn er betere instrumenten nodig om de cognitieve functie bij ouderen te monitoren.
Om klinische beoordelingen van cognitieve en gedragsfuncties van ouderen uit te voeren, hebben clinici en onderzoekers honderden screenings- en korte beoordelingsinstrumenten ontwikkeld, en verschillende tests zijn algemeen gebruikt. Een van de meest gebruikte instrumenten voor klinische beoordeling van milde cognitieve stoornissen (MCI) in academische instellingen is de: Montreal cognitieve beoordeling (MoCA).
De MoCA beoordeelt zeven cognitieve functies: uitvoerend, benoemen, aandacht, taal, abstractie, geheugen/vertraagde herinnering en oriëntatie. De domeinen geheugen/vertraagde herinnering en oriëntatie van de MoCA werden eerder geïdentificeerd als de meest gevoelige items voor cognitieve stoornissen van het vroege Alzheimer-type, wat leidde tot het concept dat geheugencodering de fundamentele factor was die werd aangevallen door het neuropathologische proces van AD. Daarom is geheugen in een klinisch hulpmiddel voor de beoordeling van cognitieve stoornissen geassocieerd met AD de centrale cognitieve factor om te overwegen, terwijl andere stoornissen, waaronder afasie, apraxie, agnosie en executieve dysfunctie, hoewel ze vaak worden verstoord door AD, gerelateerd kunnen zijn aan tot de disfunctie van neuroplastische geheugenverwerkingsmechanismen in de ondersteunende neocorticale regio's.
Hoewel de MoCA veel wordt gebruikt voor het beoordelen van MCI, vindt de toediening van de MoCA face-to-face plaats, wat tijdrovend is en een klinische ontmoeting vereist, waardoor elke toediening aanzienlijke kosten met zich meebrengt. In de loop van een assessment verhoogt de tijd die nodig is om een toets af te nemen de nauwkeurigheid van het assessment, dus toekomstige ontwikkelingen moeten met deze relatie rekening houden om efficiëntere testen te ontwikkelen.
Een cruciaal punt op dit gebied is de vereiste van cognitieve beoordeling in de loop van de tijd. Beoordeling van veranderingen in de tijd zijn belangrijk voor het opsporen en het bepalen van de progressie van stoornissen, de werkzaamheid van de behandeling en de evaluatie van therapeutische onderzoeksinterventies. De meeste van dergelijke hulpmiddelen die beschikbaar zijn, zijn niet geschikt voor, noch ontworpen voor een hoge mate van precisie, en kunnen niet gemakkelijk en regelmatig worden uitgevoerd. Er is gesuggereerd dat automatisering de oplossing is om de cognitieve beoordeling te verbeteren, maar de meeste van dergelijke inspanningen hebben weinig meer opgeleverd dan de automatisering van veelgebruikte neuropsychologische tests, en zijn niet ontwikkeld om specifiek de kritieke problemen van cognitieve beoordeling aan te pakken die nodig zijn om vroeg inzicht te krijgen in de cognitieve beoordeling. dementie en de voortgang ervan. Daarom moeten nieuwe cognitieve beoordelingsinstrumenten worden geautomatiseerd en gebaseerd op een onbeperkte bron van vergelijkbare tests, die niet worden beperkt door taal of cultuur, die een nauwkeurigheid, precisie en betrouwbaarheid bieden die geleidelijk kan worden verbeterd. Bovendien moeten dergelijke tests leuk en boeiend zijn, zodat herhaald testen eerder als een positieve dan als een vervelende ervaring wordt beschouwd. Met name online testen bieden het potentieel om aan deze behoefte te voldoen, terwijl snelle verzameling en analyse van gegevens wordt geboden en onmiddellijke feedback wordt gegeven aan deelnemende personen, clinici en onderzoekers.
De huidige studie was bedoeld om het nut te beoordelen van een online aanpassing van een CRT-paradigma (Continue Recognition Task), voor het beoordelen van de cognitieve functie in een populatie van thuiswonende individuen van wie niet was vastgesteld dat ze dementie hadden. Het CRT-paradigma wordt veel gebruikt in de academische wereld onderzoek naar het geheugen mechanismen. De CRT-benadering werd voor het eerst geïmplementeerd als een hulpmiddel voor publieksdemonstratie dat gegevens opleverde over personen die geïnteresseerd waren in geheugenproblemen. Vervolgens werd deze test online geïmplementeerd door een Frans bedrijf (HAPPYneuron, Inc.); door een in de VS gevestigd bedrijf, MemTrax, LLC (http://www.memtrax.com); door de hersenen Gezondheid Register ontwikkeld door Dr. Michael Weiner, UCSF, en zijn team ter ondersteuning van werving voor onderzoeken naar cognitieve stoornissen; en door een Chinees bedrijf SJN Biomed, LTD). Deze test heeft sinds juni 2018 gegevens verkregen van meer dan 200,000 gebruikers en wordt in verschillende landen getest.
In het huidige onderzoek is de MemTrax (MTX), een CRT-gebaseerde test, afgenomen in combinatie met de MoCA bij een zelfstandig wonende oudere populatie in Noord-Nederland. Het doel van deze studie was om de relatie tussen de prestaties op deze implementatie van de CRT en de MoCA te bepalen. De vraag was of de MTX nuttig zou zijn voor het schatten van cognitieve functies die door de MoCA worden beoordeeld, wat zou kunnen wijzen op mogelijke klinische toepasbaarheid.
MATERIALEN EN METHODES
Studie bevolking
Tussen oktober 2015 en mei 2016 is een cross-sectioneel onderzoek uitgevoerd onder thuiswonende ouderen in Noord-Nederland. Proefpersonen (≥75j) werden geworven door middel van het verspreiden van flyers en tijdens groepsbijeenkomsten voor ouderen. Potentiële proefpersonen werden thuis bezocht om te screenen op de inclusie- en exclusiecriteria voordat ze aan dit onderzoek deelnamen. Proefpersonen die leden aan (zelfgerapporteerde) dementie of die een ernstig gezichts- of gehoorverlies hadden dat van invloed zou zijn op de afname van de cognitieve tests, mochten niet deelnemen aan dit onderzoek. Daarnaast moesten proefpersonen de Nederlandse taal kunnen spreken en begrijpen en niet analfabeet zijn. De studie is uitgevoerd in overeenstemming met de Helsinki-verklaring van 1975 en alle deelnemers hebben een ondertekend geïnformeerde toestemming formulier na ontvangst van een gedetailleerde uitleg van het onderzoek.
Studieprocedure
Na deelname aan het onderzoek werd een algemene vragenlijst afgenomen, met vragen over demografische factoren, zoals leeftijd en opleidingsjaren (vanaf de basisschool), medische geschiedenis en alcoholgebruik. Na het invullen van de vragenlijst werden de MoCA- en MTX-tests in willekeurige volgorde afgenomen.
MemTrax - Onderzoek Medisch Centrum
Met dank aan MemTrax, LLC (Redwood City, CA, VS) werden gratis volledige versies van de MTX-test verstrekt. In deze test wordt een serie van 50 afbeeldingen getoond van elk maximaal drie seconden. Toen een exact herhaald beeld verscheen (25/50), kregen de proefpersonen de opdracht om zo snel mogelijk op het herhaalde beeld te reageren door op de spatiebalk te drukken (die werd aangegeven door een rood gekleurde tape). Wanneer de proefpersoon op een afbeelding reageerde, werd meteen de volgende afbeelding getoond. Na het beëindigen van de test toont het programma het percentage juiste antwoorden (MTXte corrigeren) en de gemiddelde reactietijd in seconden voor herhaalde afbeeldingen, die de tijd weerspiegelt die nodig is om op de spatiebalk te drukken bij het herkennen van een herhaalde afbeelding. Om de afmetingen van deze twee maatregelen te evenaren, is de reactietijd omgerekend naar de reactiesnelheid (MTXsnelheid) door 1 te delen door de reactietijd (dwz 1/MTXreactietijd). De testgeschiedenis van alle individuele MemTrax-scores en hun geldigheid werden automatisch online opgeslagen in het testaccount. De validiteit van alle uitgevoerde tests werd gecontroleerd, waarbij 5 of minder fout-positieve reacties, 10 of meer correcte herkenningen en een gemiddelde herkenningstijd tussen 0.4 en 2 seconden nodig waren, en alleen geldige tests werden in de analyse opgenomen.
Voordat de eigenlijke MTX-test werd afgenomen, werd de test uitgebreid uitgelegd en kregen de proefpersonen een oefentest. Dit omvatte niet alleen de test zelf, maar ook de instructie- en aftelpagina's om de deelnemer te laten wennen aan de lay-out van de site en de eerste acties die nodig waren, voordat de test begon. Om herhaling van afbeeldingen tijdens de eigenlijke test te voorkomen, werden afbeeldingen gebruikt die niet in de MemTrax-database waren opgenomen voor de oefentest.
Cognitieve beoordeling van Montreal tools
Er is toestemming verkregen van het MoCA Institute & Clinique (Quebec, Canada) om het MoCA voor dit onderzoek te gebruiken. De Nederlandse MoCA is beschikbaar in drie versies, die willekeurig aan de proefpersonen zijn toegediend. De MoCA-score is de som van de prestaties op elk afzonderlijk beoordeeld cognitief domein en heeft een maximale score van 30 punten. Volgens de officiële aanbeveling werd een extra punt toegevoegd als de deelnemer ≤12 jaar onderwijs had (indien <30 punten). De officiële testinstructies werden als richtlijn gebruikt tijdens het afnemen van de tests. De tests werden afgenomen door drie getrainde onderzoekers en het afnemen van één test duurde ongeveer 10 tot 15 minuten.
MemTrax-gegevensanalyse
Op basis van de resultaten van de MoCA, die gecorrigeerd was voor onderwijs, werden de proefpersonen verdeeld in twee groepen met cognitieve status: normale cognitie (NC) versus milde cognitieve stoornis (MCI). De MoCA-score van 23 werd gebruikt als grenswaarde voor MCI (scores van 22 en lager werden als MCI beschouwd), omdat werd aangetoond dat deze score over het algemeen 'de beste diagnostische nauwkeurigheid over een reeks parameters' liet zien in vergelijking met de aanvankelijk aanbevolen score van 26 of de waarden van 24 of 25. Voor alle analyses werd de gecorrigeerde MoCA-score gebruikt zoals deze score wordt gebruikt in klinische settings.
De MTX-test geeft twee uitkomsten, namelijk MTXreactietijd, die werd omgezet naar MTXsnelheid door 1/MTXreactietijd, en MTXte corrigeren.
Statistische analyses zijn uitgevoerd met R (versie 1.0.143, Rstudio Team, 2016). Normaliteit werd gecontroleerd voor alle variabelen door de Shapiro-Wilk-test. Variabelen van de gehele onderzoekspopulatie en van de NC- en MCI-groepen werden gerapporteerd als het gemiddelde ± standaarddeviatie (SD), mediaan en interkwartielbereik (IQR) of als aantal en percentage. Onafhankelijke steekproef-T-tests en Wilcoxon Sum Rank-tests voor continue variabelen en Chi-kwadraattests voor categorische variabelen werden uitgevoerd om de kenmerken van de NC- en MCI-groep te vergelijken. De niet-parametrische Kruskal-Wallis-test werd gebruikt om te bepalen of de drie versies van de MoCA en de drie beheerders de MoCA-resultaten beïnvloedden. Daarnaast werd een onafhankelijke T-test of Wilcoxon Sum Rank-test uitgevoerd om te bepalen of de volgorde van toediening van de MoCA en MTX de testresultaten beïnvloedde (bijv. MoCA-score, MTXte corrigeren, en MTXsnelheid). Dit werd uitgevoerd door te bepalen of de gemiddelde scores verschillend waren voor de proefpersonen die eerst de MoCA en daarna de MemTrax ontvingen of die eerst de MTX en daarna de MoCA ontvingen.
Pearson correlatie tests werden berekend om de relatie tussen MTX en MoCA en tussen beide MemTrax te beoordelen testresultaten, bijvoorbeeld MTXspeed en MTXcorrect. Een eerder uitgevoerde berekening van de steekproefomvang toonde aan dat voor een eenzijdige Pearson-correlatietest (power = 80%, α = 0.05), met de aanname van een gemiddelde effectgrootte (r = 0.3), was een minimale steekproefomvang van n = 67 nodig. Polyseriële correlatietests werden berekend om de relatie tussen de MTX-testresultaten en de afzonderlijke MoCA-domeinen te beoordelen met behulp van het psych-pakket in R.
De equivalente MoCA-score voor gegeven MemTrax-scores werd berekend door de gemiddelde MemTrax-score voor elke mogelijke MoCA-score te berekenen en lineaire regressie werd uitgevoerd om de vergelijkingen met betrekking tot deze maatregelen te schatten. Om de afkapwaarden van de MemTrax-test voor MCI gemeten door MoCA en de bijbehorende gevoeligheids- en specificiteitswaarden te bepalen, werd bovendien een ROC-analyse (Receiver Operator Characteristic) uitgevoerd met behulp van het pROC-pakket in R. Niet-parametrisch gestratificeerde bootstrapping (n = 2000) werd gebruikt om het gebied onder de curven (AUC's) en de bijbehorende betrouwbaarheidsintervallen te vergelijken. De optimale cutoff-score werd berekend met de Youden-methode, die de echte positieven maximaliseert en valse positieven minimaliseert.
Voor alle statistische analyses werd een tweezijdige p-waarde van <0.05 beschouwd als drempel voor statistische significantie, behalve voor de analyse om de relatie tussen MTX en MoCA te beoordelen (dwz correlatieanalyse en eenvoudige lineaire regressie) waarvoor een één- eenzijdige p-waarde van <0.05 werd als significant beschouwd.
MemTrax-RESULTATEN
vakken
In totaal werden 101 proefpersonen in dit onderzoek geïncludeerd. Gegevens van 19 personen werden uitgesloten van analyse, aangezien de MemTrax-testresultaten van 12 proefpersonen niet door het programma werden opgeslagen, 6 proefpersonen ongeldige MemTrax-testresultaten hadden en één proefpersoon een MoCA-score van 8 punten had, wat wijst op ernstige cognitieve stoornissen, wat een uitsluitingscriterium. Daarom werden gegevens van 82 proefpersonen in de analyse opgenomen. Er werden geen significante verschillen gevonden in de MoCA-testresultaten tussen de verschillende versies van de MoCA en tussen de beheerders. Bovendien had de volgorde van toediening van de test geen significant effect op de testscores (MoCA, MTXsnelheid, MTXte corrigeren). Op basis van de MoCA-testresultaten werden proefpersonen in de NC- of MCI-groep geplaatst (bijv. MoCA ≥ 23 respectievelijk MoCA <23). De kenmerken van de proefpersonen voor de totale onderzoekspopulatie en de NC- en MCI-groepen zijn weergegeven in Tabel 1. Er waren geen significante verschillen tussen de groepen, behalve de mediane MoCA-scores (25 (IQR: 23 – 26) versus 21 (IQR: 19 – 22). ) punten, Z = -7.7, p <0.001).
tafel 1
Onderwerp kenmerken
| Totale onderzoekspopulatie (n = 82) | NC (n = 45) | MCI (n = 37) | p | |
| Leeftijd (j) | 83.5 5.2 ± | 82.6 4.9 ± | 84.7 5.4 ± | 0.074 |
| Vrouw, nr. (%) | 55 (67) | 27 (60) | 28 (76) | 0.133 |
| Onderwijs (j) | 10.0 (8.0-13.0) | 11.0 (8.0-14.0) | 10.0 (8.0-12.0) | 0.216 |
| Alcoholgebruik (# glazen/week) | 0 (0-4) | 0 (0-3) | 0 (0-5) | 0.900 |
| MoCA-score (# punten) | 23 (21-25) | 25 (23-26) | 21 (19-22) | na |
Waarden worden uitgedrukt als gemiddelde ± sd, mediaan (IQR) of als getal met percentage.
Cognitieve status gemeten door MemTrax
De cognitieve status werd gemeten met de MTX-test. Figuur 1 toont de resultaten van de cognitieve test uitkomsten van NC- en MCI-onderwerpen. De gemiddelde MTX-scores (bijv. MTXsnelheid en MTXte corrigeren) waren significant verschillend tussen de twee groepen. NC-onderwerpen (0.916 ± 0.152 s-1) hadden een significant snellere reactiesnelheid vergeleken met MCI-proefpersonen (0.816 ± 0.146 s-1); t(80) = 3.01, p = 0.003) (Fig. 1A). Bovendien scoorden NC-proefpersonen beter op de MTXte corrigeren variabel dan MCI-proefpersonen (respectievelijk 91.2 ± 5.0% versus 87.0 ± 7.7%; tw (59) = 2.89, p = 0.005) (Fig. 1B).
Fig.1
Boxplots van MTX-testresultaten voor NC- en MCI-groepen. A) MTXsnelheid testresultaat en B) MTXte corrigeren testresultaat. Beide uitkomstvariabelen van de MTX-tests zijn significant lager in de MCI-groep in vergelijking met NC. De lichtgrijze kleur geeft NC-onderwerpen aan, terwijl de donkergrijze kleur MCI-onderwerpen aangeeft.
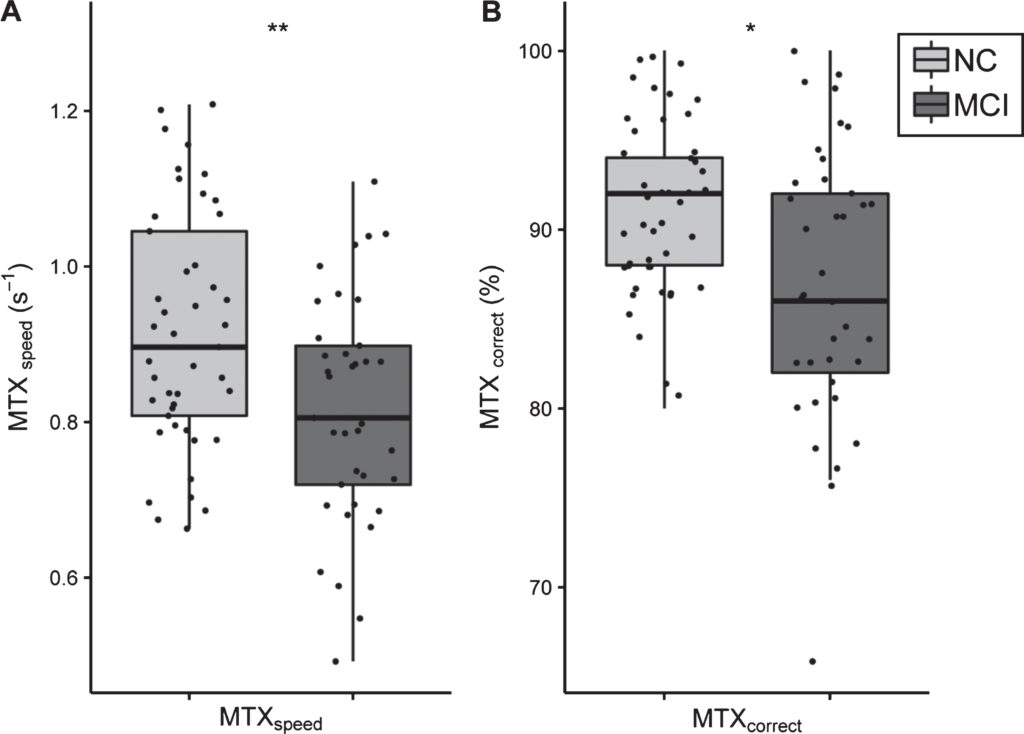
Boxplots van MTX-testresultaten voor NC- en MCI-groepen. A) MTXspeed-testresultaat en B) MTXcorrect-testresultaat. Beide uitkomstvariabelen van de MemTrax-tests zijn significant lager in de MCI-groep in vergelijking met NC. De lichtgrijze kleur geeft NC-onderwerpen aan, terwijl de donkergrijze kleur MCI-onderwerpen aangeeft.
Correlatie tussen MemTrax en MOCA
Associaties tussen MTX-testscores en MoCA worden getoond in Fig. 2. Beide MTX-variabelen waren positief geassocieerd met de MoCA. MTXsnelheid en MoCA toonde een significante correlatie van r = 0.39 (p = 0.000), en de correlatie tussen MTXte corrigeren en MoCA was r = 0.31 (p = 0.005). Er was geen verband tussen MTXsnelheid en MTXte corrigeren.
Fig.2
Associaties tussen A) MTXsnelheid en MoCA; B) MTXte corrigeren en MoCA; C) MTXte corrigeren en MTXsnelheid. NC- en MCI-onderwerpen worden aangegeven met respectievelijk stippen en driehoeken. In de rechterbenedenhoek van elke grafiek wordt de rho en de bijbehorende p-waarde getoond van de correlatie tussen de twee variabelen.
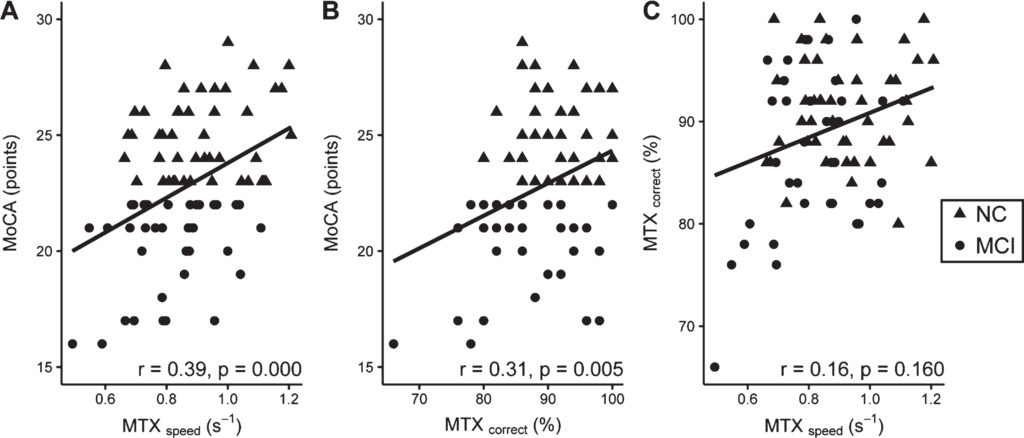
Associaties tussen A) MTXspeed en MoCA; B) MTXcorrect en MoCA; C) MTXcorrect en MTXspeed. NC- en MCI-onderwerpen worden aangegeven met respectievelijk stippen en driehoeken. In de rechterbenedenhoek van elke grafiek wordt de rho en de bijbehorende p-waarde getoond van de correlatie tussen de twee variabelen.
Associaties tussen A) MTXspeed en MoCA; B) MTXcorrect en MoCA; C) MTXcorrect en MTXspeed. NC- en MCI-onderwerpen worden aangegeven met respectievelijk stippen en driehoeken. In de rechterbenedenhoek van elke grafiek worden de rho en de bijbehorende p-waarde getoond van de correlatie tussen de twee variabelen.[/caption]
Er werden polyseriële correlaties berekend tussen de MemTrax-testscores en de MoCA-domeinen om de associatie van elk domein met de MemTrax-statistieken te bepalen. De polyseriële correlaties worden weergegeven in Tabel 2. Meerdere domeinen van de MoCA waren significant gecorreleerd met MTXsnelheid . Het domein "abstractie" vertoonde de hoogste correlatie, hoewel matig, met MTXsnelheid (r = 0.35, p = 0.002). De domeinen "naamgeving" en "taal" vertoonden een zwakke tot matige significante associatie met MTXsnelheid (r = 0.29, p = 0.026 en r = 0.27, p = 0.012, respectievelijk). MTXte corrigeren was niet significant geassocieerd met de MoCA-domeinen, behalve een zwakke correlatie met het domein "visuospatial" (r = 0.25, p = 0.021).
tafel 2
Polyseriële correlaties van MTX-testresultaten met MoCA-domeinen
| MTXsnelheid | MTXte corrigeren | |||
| r | p | r | p | |
| Visueel-ruimtelijk | 0.22 | 0.046 | 0.25 | 0.021 |
| Benoemen | 0.29 | 0.026 | 0.24 | 0.063 |
| Aandacht | 0.24 | 0.046 | 0.09 | 0.477 |
| Taal | 0.27 | 0.012 | 0.160 | 0.165 |
| Abstractie | 0.35 | 0.002 | 0.211 | 0.079 |
| Terugroepen | 0.15 | 0.159 | 0.143 | 0.163 |
| Beeldoriëntatie | 0.21 | 0.156 | 0.005 | 0.972 |
Opmerking: significante correlaties zijn vetgedrukt weergegeven.
MemTrax-scores en geschatte grenswaarden voor MCI
Om de corresponderende scores van MemTrax en MoCA te bepalen, werden de MemTrax-scores van elke MoCA-score gemiddeld en werd lineaire regressie berekend om de relaties en bijbehorende vergelijkingen te voorspellen. De resultaten van de lineaire regressie gaven aan dat MTXsnelheid verklaarde 55% van de variantie in MoCA (R2 = 0.55, p = 0.001). De variabele MTXte corrigeren verklaarde 21% van de variantie in MoCA (R2 = 0.21, p = 0.048). Op basis van de vergelijkingen van deze relaties werden equivalente MoCA-scores berekend voor gegeven MTX-scores, die worden weergegeven in Tabel 3. Op basis van deze vergelijkingen werden de corresponderende grenswaarden (bijv. MoCA-score van 23 punten) voor MTXsnelheid en MTXte corrigeren zijn 0.87 s-1 en 90%. Daarnaast werd er meervoudige lineaire regressie op beide MemTrax-variabelen uitgevoerd, maar de variabele MTXte corrigeren droeg niet significant bij aan het model en daarom worden de resultaten niet getoond.
tafel 3
Voorgestelde equivalente MoCA-score voor gegeven MemTrax-scores
| MoCA (punten) | Equivalente MTXsnelheid (s-1)a | CI van voorspelling met MTXsnelheid (punten) | Equivalente MTXte corrigeren (%)b | CI van voorspelling met MTXte corrigeren (punten) |
| 15 | 0.55 | 7 - 23 | 68 | 3 - 28 |
| 16 | 0.59 | 8 - 24 | 71 | 5 - 28 |
| 17 | 0.63 | 10 - 24 | 73 | 6 - 28 |
| 18 | 0.67 | 11 - 25 | 76 | 8 - 28 |
| 19 | 0.71 | 12 - 26 | 79 | 9 - 29 |
| 20 | 0.75 | 13 - 27 | 82 | 11 - 29 |
| 21 | 0.79 | 14 - 28 | 84 | 12 - 30 |
| 22 | 0.83 | 15 - 29 | 87 | 13 - 30 |
| 23 | 0.87 | 16 - 30 | 90 | 14 - 30 |
| 24 | 0.91 | 17 - 30 | 93 | 15 - 30 |
| 25 | 0.95 | 18 - 30 | 95 | 16 - 30 |
| 26 | 0.99 | 19 - 30 | 98 | 16 - 30 |
| 27 | 1.03 | 20 - 30 | 100 | 17 - 30 |
| 28 | 1.07 | 21 - 30 | 100 | 17 - 30 |
| 29 | 1.11 | 21 - 30 | 100 | 17 - 30 |
| 30 | 1.15 | 22 - 30 | 100 | 17 - 30 |
aGebruikte vergelijking: 1.1 + 25.2 *MTXsnelheid; b Gebruikte vergelijking: –9.7 + 0.36 *MTXte corrigeren.
Daarnaast werden MTX-grenswaarden en de bijbehorende sensitiviteit en specificiteit bepaald via een ROC-analyse. De ROC-curven van de MemTrax-variabelen worden weergegeven in Fig. 3. De AUC's voor MTXsnelheid en MTXte corrigeren zijn respectievelijk 66.7 (BI: 54.9 – 78.4) en 66.4% (BI: 54.1 – 78.7). De AUC's van de MemTrax-variabelen die werden gebruikt om de door MoCA vastgestelde MCI te beoordelen, waren niet significant verschillend. Tabel 4 toont de gevoeligheid en specificiteit van verschillende afkappunten van de MemTrax-variabelen. De optimale cutoff-scores, die echte positieven maximaliseerden en valse positieven minimaliseerden, voor MTXsnelheid en MTXte corrigeren waren 0.91 s-1 (gevoeligheid = 48.9% specificiteit = 78.4%) en 85% (gevoeligheid = 43.2%; specificiteit = 93.3%) respectievelijk.
Fig.3
ROC-curven van de MTX-testresultaten om MCI beoordeeld door MoCA te beoordelen. De stippellijn geeft MTX . aansnelheid en de ononderbroken lijn MTXte corrigeren. De grijze lijn stelt de referentielijn van 0.5 voor.
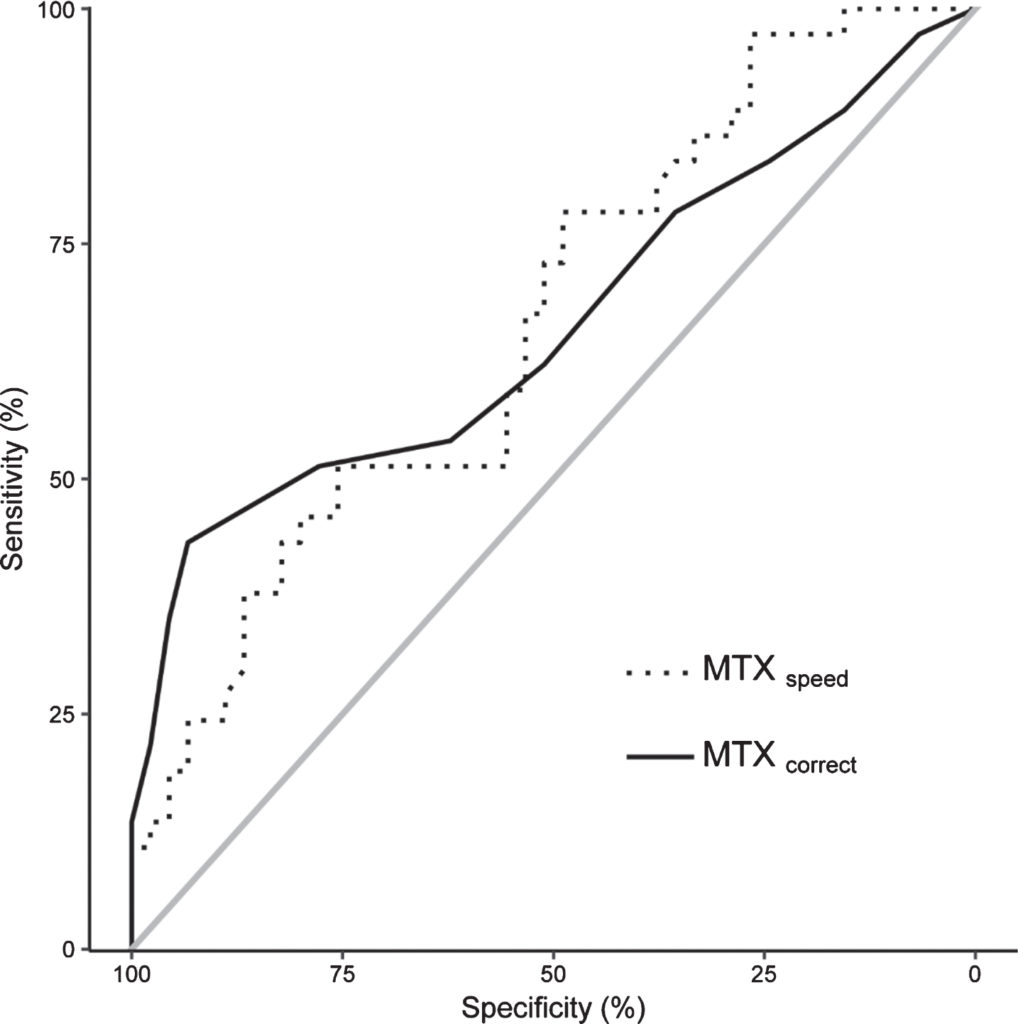
ROC-curven van de MTX-testresultaten om MCI beoordeeld door MoCA te beoordelen. De stippellijn geeft MTXspeed aan en de ononderbroken lijn MTXcorrect. De grijze lijn stelt de referentielijn van 0.5 voor.
tafel 4
MTXsnelheid en MTXte corrigeren afkappunten en bijbehorende specificiteit en gevoeligheid
| Afkappunt | Tp (#) | tn (#) | FP (#) | Fn (#) | Specificiteit (%) | Gevoeligheid (%) | |
| MTXsnelheid | 1.20 | 37 | 1 | 44 | 0 | 2.2 | 100 |
| 1.10 | 36 | 7 | 38 | 1 | 15.6 | 97.3 | |
| 1.0 | 33 | 13 | 32 | 4 | 28.9 | 89.2 | |
| 0.90 | 28 | 22 | 23 | 9 | 48.9 | 75.7 | |
| 0.80 | 18 | 34 | 11 | 19 | 75.6 | 48.6 | |
| 0.70 | 9 | 41 | 4 | 28 | 91.1 | 24.3 | |
| 0.60 | 3 | 45 | 0 | 34 | 100 | 8.1 | |
| MTXte corrigeren | 99 | 36 | 3 | 42 | 1 | 97.3 | 6.7 |
| 95 | 31 | 11 | 34 | 6 | 83.8 | 24.4 | |
| 91 | 23 | 23 | 22 | 14 | 62.2 | 51.1 | |
| 89 | 20 | 28 | 17 | 17 | 54.1 | 62.2 | |
| 85 | 16 | 42 | 3 | 21 | 43.2 | 93.3 | |
| 81 | 8 | 44 | 1 | 29 | 21.6 | 97.8 | |
| 77 | 3 | 45 | 0 | 34 | 8.1 | 100 |
tp, echt positief; tn, echt negatief; fp, vals positief; fn, vals negatief.
DISCUSSIE
Deze studie is opgezet om de online MemTrax-tool, een CRT-gebaseerde test, te onderzoeken met de MoCA als referentie. Er is gekozen voor de MoCA omdat deze test momenteel veel wordt gebruikt om te screenen op MCI. De optimale afkappunten voor de MoCA zijn echter niet duidelijk vastgesteld [28]. De vergelijkingen van de individuele metingen van MemTrax met de MoCA laten zien dat een eenvoudige, korte online test een aanzienlijk deel van de variantie in cognitief functioneren en cognitieve stoornissen kan vastleggen. In deze analyse werd het sterkste effect gezien voor de snelheidsmaat. De correctheidsmaat liet een minder robuust verband zien. Een significante bevinding was dat er geen correlatie werd waargenomen tussen de MTX-snelheids- en correctheidsmetingen, wat aangeeft dat deze variabelen verschillende componenten van de onderliggende waarde meten. hersenverwerkingsfunctie. Er werd dus geen indicatie gevonden van een wisselwerking tussen snelheid en nauwkeurigheid bij de proefpersonen. Daarnaast werden twee verschillende methoden gebruikt om de afkapwaarden van de MemTrax-geheugentest te schatten om MCI te detecteren. Deze methoden toonden aan dat voor de uitkomsten snelheid en correctheid een score onder het bereik van respectievelijk 0.87 – 91 s-1 en 85 - 90% zijn een indicatie dat personen die onder een van die bereiken scoren, meer kans hebben op MCI. Een "kosten-waardigheidsanalyse" zou aangeven op welk punt een persoon moet worden geadviseerd een arts te raadplegen over het uitvoeren van uitgebreidere tests om te screenen op MCI [8-35].
In de huidige studie werd gevonden dat de domeinen "naamgeving", "taal" en "abstractie" gemeten door de MoCA de hoogste correlaties hadden met een van de MemTrax-uitkomsten, hoewel de correlaties zwak tot matig waren. Dit is in tegenstelling tot wat werd verwacht, aangezien eerdere studies hebben aangetoond bij het onderzoeken van de Mini-mentaal staatsexamen met behulp van de Item Response Theory, dat de domeinen "geheugen/vertraagde herinnering" en "oriëntatie" het meest gevoelig waren voor vroege AD [12]. Op dit zeer vroege fase van cognitieve disfunctie lijkt het erop dat MoCA-indicatoren van subtiele stoornissen in naamgeving, taal en abstractie gevoeliger zijn voor MCI dan de metingen van geheugen en oriëntatie, consistent met eerdere bevindingen in een Item Response Theory-analyse van de MoCA [36]. Verder, de MemTrax-meting van herkenningssnelheid lijkt deze vroege stoornis vóór herkenningsgeheugen te weerspiegelen zoals gemeten door MTX (wat een aanzienlijk plafondeffect heeft). Dit sterrenbeeld van effecten suggereert dat de complexe aspecten van de pathologie die MCI veroorzaakt, de vroege hersenen weerspiegelen veranderingen die moeilijk te conceptualiseren waren met eenvoudige neurocognitieve benaderingen en die in feite de progressie van de onderliggende neuropathologie kunnen weerspiegelen [37].
Sterke punten in de huidige studie zijn dat de steekproefomvang (n = 82) meer dan voldoende was om de correlaties tussen de MoCA en MTX in deze relatief oude populatie te detecteren. Daarnaast is bij alle proefpersonen een oefentoets afgenomen, zodat ouderen die niet gewend zijn aan een computer de kans krijgen om zich aan te passen aan de testomgeving en de apparatuur. Vergeleken met de MoCA gaven proefpersonen aan dat de MemTrax leuker was om te doen, terwijl de MoCA meer als een examen aanvoelde. De leeftijd van de proefpersonen en hun onafhankelijkheid van de gemeenschap beperkten de focus van de analyse tot deze selecte groep van relatief goed functionerende individuen, maar deze groep is een van de moeilijkste voor het identificeren van beperkingen.
Merk op dat, hoewel het als een standaard screeningstest wordt beschouwd, de MoCA slechts een test is om de mogelijke aanwezigheid van MCI aan te geven, geen diagnostisch hulpmiddel of een absolute meting van cognitieve disfunctie. Dus dienovereenkomstig is de vergelijking van de MoCA en MTX relatief, en beide hebben waarschijnlijk onafhankelijke variantie in de MCI-identificatie vastgelegd. Dienovereenkomstig is een belangrijk punt in de literatuur de poging geweest om het nut van de MoCA te definiëren [38], de validatie ervan [39], het vaststellen van normatieve scores [40], de vergelijking met andere korte cognitieve beoordelingen [41-45] en het nut ervan als screeningsinstrument voor MCI [46] (beoordeeld door Carson et al., 2017 [28]), evenals de toepasbaarheid van een elektronische versie [47]. Dergelijke analyses omvatten onderzoek van gevoeligheid en specificiteit, meestal met behulp van ROC-analyse met meting van "gebied onder de curve", en de aanbeveling van een grenswaarde voor "diagnose". Echter, bij gebrek aan enige benadering om absoluut te bepalen waar een individu zich bevindt op het continuüm van lichte beperkingen, samen met de enorme variabiliteit in de onderliggende hersenfuncties al dergelijke hulpmiddelen dragen bij aan die verslechtering en kunnen alleen een probabilistische schatting geven. Door correlaties tussen verschillende metingen te geven, wordt alleen aangetoond dat de onderliggende aandoening correct wordt aangepakt, maar de werkelijke biologische toestand kan met deze benadering niet precies worden gedefinieerd. Hoewel analyses op een hoger niveau praktisch nuttig kunnen zijn in een klinische setting, vereist het vaststellen van een dergelijk nut extra aandacht voor vier factoren: de prevalentie van de aandoening in de populatie; de kosten van de test, de kosten van de fout-positieve resultaten en het materiële voordeel van een echt positieve diagnose [8, 35].
Een belangrijke een deel van het probleem bij het evalueren van AD en de bijbehorende cognitieve stoornissen is dat er geen echte zijn "stadia" [48], maar eerder een temporeel continuüm van progressie [8, 17, 49]. Het onderscheid tussen 'normaal' en MCI is eigenlijk veel moeilijker dan een van deze aandoeningen te onderscheiden van de milde dementie geassocieerd met n.Chr. [50, 51]. Gebruikmakend van het concept van "moderne testtheorie", wordt het probleem om te bepalen waar op het continuüm een individu zich het meest waarschijnlijk binnen een bepaald betrouwbaarheidsintervalbereik bevindt, gegeven een bepaalde testscore. Om dergelijke vaststellingen te doen, zijn nauwkeurigere beoordelingen nodig dan de meeste korte cognitieve tests, maar die worden geleverd door MTX. Verhoogde precisie en verwijdering van waarnemersbias met gecomputeriseerd testen is een veelbelovende richting. Ook biedt een gecomputeriseerde test, zoals de MemTrax, de mogelijkheid van een onbeperkt aantal vergelijkbare tests, waardoor de variantie van de waardeverminderingsschatting substantieel wordt verkleind. Verder kunnen computergestuurde tests in principe veel van de geheugengerelateerde domeinen testen die door AD zijn aangetast. In deze studie werd MTX niet vergeleken met de talrijke andere computergestuurde tests die zijn gemaakt (zie inleiding), maar geen van de tot nu toe beschikbare tests maakt gebruik van de krachtige aanpak die een CRT biedt. De verdere ontwikkeling van geautomatiseerd testen is een belangrijk punt voor verdere aandacht en ondersteuning. Eindelijk, training effecten kunnen worden meegenomen in de analyses.
Op dit moment is geautomatiseerd online testen geen gevestigde benadering screenen op dementie, cognitieve stoornissen beoordelen of een klinische diagnose stellen. De kracht en het potentieel van deze benadering, met name het gebruik van CRT, om episodisch (kortetermijn) geheugen te evalueren, is echter enorm en zal waarschijnlijk cruciaal zijn in toekomstige toepassingen van cognitieve evaluatie, waaronder dementie screening en beoordeling, monitoring van postoperatieve verwarring, vaststelling van mentale capaciteit voor besluitvorming, detectie van tekorten na een hersenschudding en schatting van mogelijke beperkingen voor de rijveiligheid. In deze studie wordt aangetoond dat MemTrax een aanzienlijk deel van de variantie van cognitieve stoornissen kan vastleggen. Daarnaast worden voor de MTX-variabelen afkapwaarden gepresenteerd die gelijk zijn aan de MoCA-afkapscore voor MCI. Voor toekomstig onderzoek wordt voorgesteld om te onderzoeken in grotere, duidelijker gedefinieerde populaties om MemTrax te vestigen als screeningstool voor MCI. Een dergelijke populatie moet klinische steekproeven bevatten waarin diagnostische problemen zo nauwkeurig mogelijk kunnen worden gedefinieerd en proefpersonen in de loop van de tijd kunnen worden gevolgd met MTX en andere cognitieve tests. Dergelijke analyses kunnen variaties in de trajecten van cognitieve achteruitgang bepalen, gerelateerd aan zowel normale veroudering als verschillende pathologische aandoeningen. Naarmate geautomatiseerde tests en registers zich ontwikkelen, wordt er veel meer informatie over niveaus van gezondheid beschikbaar zal komen en ongetwijfeld zal leiden tot een grote verbetering van de gezondheidszorg en hopelijk benaderingen om aandoeningen zoals AD te voorkomen.
ACKNOWLEDGMENTS
We willen Anne van der Heijden, Hanneke Rasing, Esther Sinnema en Melinda Lodders bedanken voor hun werk in dit onderzoek. Daarnaast willen we MemTrax, LLC bedanken voor het verstrekken van gratis volledige versies van de MemTrax-test. Dit werk maakt deel uit van een onderzoeksprogramma dat wordt gefinancierd door de Provincie Fryslân (01120657), Nederland en Alfasigma Nederland BV (directe bijdrage aan subsidienummer 01120657). Gepubliceerd: 12 februari 2019
REFERENTIES
| [1] | Jorm AF, Jolley D (1998) De incidentie van dementie: een meta-analyse. Neurologie 51, 728-733. |
| [2] | Hebert LE, Weuve. J, Scherr PA, Evans DA (2013) Ziekte van Alzheimer in de Verenigde Staten (2010-2050) geschat op basis van de volkstelling van 2010. Neurologie 80, 1778-1783. |
| [3] | Weuve. J, Hebert LE, Scherr PA, Evans DA (2015) Prevalentie van Ziekte van Alzheimer in Amerikaanse staten. Epidemiologie 26, e4-6. |
| [4] | Brookmeyer R, Abdalla N, Kawas CH, Corrada MM (2018) Voorspelling van de prevalentie van preklinische en klinische Ziekte van Alzheimer in de Verenigde Staten. Alzheimerdementie 14, 121-129. |
| [5] | Borson S, Frank L, Bayley PJ, Boustani M, Dean M, Lin PJ, McCarten JR, Morris JC, Zalm DP, Schmitt FA, Stefanacci RG, Mendiondo MS, Peschin S, Hall EJ, Fillit H, Ashford JW (2013) Verbetering van de dementiezorg: de rol van screening en detectie van cognitieve stoornissen. Alzheimerdementie 9, 151-159. |
| [6] | Loewenstein DA, Curiel RE, Duara R, Buschke H (2018) Nieuwe cognitieve paradigma's voor de detectie van geheugenstoornissen bij preklinische ziekte van Alzheimer. Beoordeling 25, 348-359. |
| [7] | Thyrian JR, Hoffmann W, Eichler T (2018) Redactioneel: Vroege herkenning van dementie in actuele problemen en concepten in de eerste lijn. Curr Alzheimer Res 15, 2-4. |
| [8] | Ashford JW (2008) Screening op geheugenstoornissen, dementie en Ziekte van Alzheimer. Veroudering Gezondheid 4, 399-432. |
| [9] | Yokomizo JE, Simon SS, Bottino CM (2014) Cognitieve screening voor dementie in de eerste lijn: een systematische review. Int Psychogeriatrie 26, 1783-1804. |
| [10] | Bayley PJ, Kong JY, Mendiondo M, Lazzeroni LC, Borson S, Buschke H, Dean M, Fillit H, Frank L, Schmitt FA, Peschin S, Finkel S, Austen M, Steinberg C, Ashford JW (2015) Bevindingen van de Nationale geheugenscreening Dag programma. J Am Geriatr Soc 63, 309-314. |
| [11] | Nasreddine ZS, Phillips NA, Bedirian V, Charbonneau S, Whitehead V, Collin I, Cummings JL, Chertkow H (2005) De Montreal Cognitive Assessment, MoCA: een kort screeningsinstrument voor milde cognitieve stoornissen. J Am Geriatr Soc 53, 695-699. |
| [12] | Ashford JW, Kolm P, Colliver JA, Bekian C, Hsu LN (1989) Alzheimer-patiëntevaluatie en de mini-mentale toestand: analyse van itemkarakteristieken. J Gerontol 44, P139-P146. |
| [13] | Ashford JW, Jarvik L (1985) Ziekte van Alzheimer: maakt neuronplasticiteit vatbaar voor axonale neurofibrillaire degeneratie? N Engl J Med 313, 388-389. |
| [14] | Ashford JW (2015) Behandeling van Ziekte van Alzheimer: de erfenis van de cholinerge hypothese, neuroplasticiteit en toekomstige richtingen. J Alzheimer Dis 47, 149-156. |
| [15] | Larner AJ (2015) Op prestaties gebaseerd cognitief screening instrumenten: een uitgebreide analyse van de afweging tussen tijd en nauwkeurigheid. Diagnostiek (Basel) 5, 504-512. |
| [16] | Ashford JW, Shan M, Butler S, Rajasekar A, Schmitt FA (1995) Tijdelijke kwantificering van Ziekte van Alzheimer ernst: 'tijdindex'-model. Dementie 6, 269-280. |
| [17] | Ashford JW, Schmitt FA (2001) Modellering van het tijdsverloop van Alzheimer dementie. Curr Psychiatrie Rep 3, 20–28. |
| [18] | Li K , Chan W , Doody RS , Quinn J , Luo S (2017) Voorspelling van conversie naar Ziekte van Alzheimer met longitudinale metingen en time-to-event data. J Alzheimer Dis 58, 361-371. |
| [19] | Dede E, Zalonis I, Gatzonis S, Sakas D (2015) Integratie van computers in cognitieve beoordeling en mate van volledigheid van veelgebruikte geautomatiseerde batterijen. Neurol Psychiatry Brain Res 21, 128-135. |
| [20] | Siraly E, Szabo A, Szita B, Kovacs V, Fodor Z, Marosi C, Salacz P, Hidasi Z, Maros V, Hanak P, Csibri E, Csukly G (2015) Toezicht op de vroege tekenen van cognitieve achteruitgang bij ouderen door computerspellen: een MRI-onderzoek. PLoS One 10, e0117918. |
| [21] | Gates NJ, Kochan NA (2015) Geautomatiseerde en online neuropsychologische tests voor cognitie op latere leeftijd en neurocognitieve stoornissen: zijn we er al? Curr Opin Psychiatrie 28, 165-172. |
| [22] | Zygouris S, Tsolaki M (2015) Geautomatiseerde cognitieve tests voor oudere volwassenen: een beoordeling. Am J Alzheimers Dis Other Demen 30, 13–28. |
| [23] | Possin KL, Moskowitz T, Erlhoff SJ, Rogers KM, Johnson ET, Steele NZR, Higgins JJ, Stiver. J, Alioto AG, Farias ST, Miller BL, Rankin KP (2018) Brain Health Beoordeling voor het opsporen en diagnosticeren van neurocognitieve stoornissen. J Am Geriatr Soc 66, 150–156. |
| [24] | Shepard RN, Teghtsoonian M (1961) Behoud van informatie onder omstandigheden die een stabiele toestand benaderen. J Exp Psychol 62, 302-309. |
| [25] | Wixted JT , Goldinger SD , Squire LR , Kuhn JR , Papesh MH , Smith KA , Treiman DM , Steinmetz PN (2018) Codering van episodisch geheugen in de menselijk zeepaardje. Proc Natl Acad Sci VS 115, 1093-1098. |
| [26] | Ashford JW, Gere E, Bayley PJ (2011) Meten geheugen in grote groepsinstellingen met behulp van een continue herkenningstest. J Alzheimer Dis 27, 885-895. |
| [27] | Weiner MW, Nosheny R, Camacho M, Truran-Sacrey D, Mackin RS, Flenniken D, Ulbricht A, Insel P, Finley S, Fockler J, Veitch D (2018) Brain Health Register: een op internet gebaseerd platform voor werving, beoordeling en longitudinale monitoring van deelnemers voor neurowetenschappelijke studies. Alzheimerdementie 14, 1063-1076. |
| [28] | Carson N, Leach L, Murphy KJ (2018) Een heronderzoek van Montreal Cognitive Assessment (MoCA) cutoff-scores. Int J Geriatr Psychiatrie 33, 379-388. |
| [29] | Faul F, Erdfelder E, Buchner A, Lang AG (2009) Statistische poweranalyses met G * Power 3.1: tests voor correlatie- en regressieanalyses. Gedragsonderzoek Methoden 41, 1149-1160. |
| [30] | Drasgow F (1986) Polychore en polyseriële correlaties. In Encyclopedia of Statistical Sciences, Kotz S, Johnson NL, Read CB, eds. John Wiley & Sons, New York, blz. 68-74. |
| [31] | Revelle WR (2018) psych: procedures voor persoonlijkheids- en psychologisch onderzoek. Northwestern University, Evanston, IL, VS. |
| [32] | Robin X, Turck N, Hainard A, Tiberti N, Lisacek F, Sanchez JC, Muller M (2011) pROC: een open-sourcepakket voor R en S+ om ROC-curven te analyseren en te vergelijken. BMC Bioinformatica 12, 77. |
| [33] | Fluss R, Faraggi D, Reiser B (2005) Schatting van de Youden-index en het bijbehorende afkappunt. Biom J 47, 458-472. |
| [34] | Youden WJ (1950) Index voor het beoordelen van diagnostische tests. Kreeft 3, 32-35. |
| [35] | Kraemer H (1992) Evaluatie van medische tests, Sage Publications, Inc., Newbury Park, CA. |
| [36] | Tsai CF, Lee WJ, Wang SJ, Shia BC, Nasreddine Z, Fuh JL (2012) Psychometrics of the Montreal Cognitive Assessment (MoCA) en zijn subschalen: validatie van de Taiwanese versie van de MoCA en een analyse van de itemresponstheorie. Int. Psychogeriatr 24, 651-658. |
| [37] | Aschenbrenner AJ, Gordon BA, Benzinger TLS, Morris JC, Hassenstab JJ (2018) Invloed van tau PET, amyloïde PET en hippocampusvolume op cognitie bij de ziekte van Alzheimer. Neurologie 91, e859-e866. |
| [38] | Puustinen. J, Luostarinen L, Luostarinen M, Pulliainen V, Huhtala H, Soini M, Suhonen J (2016) Het gebruik van MoCA en andere cognitieve tests bij de evaluatie van cognitieve stoornissen bij oudere patiënten die een artroplastiek ondergaan. Geriatr Orthop Surg Rehabil 7, 183-187. |
| [39] | Chen KL , Xu Y , Chu AQ , Ding D , Liang XN , Nasreddine ZS , Dong Q , Hong Z , Zhao QH , Guo QH (2016) Validatie van de Chinese versie van Montreal Cognitive Assessment Basic voor het screenen van milde cognitieve stoornissen. J Am Geriatr Soc 64, e285-e290. |
| [40] | Borland E, Nagga K, Nilsson PM, Minthon L, Nilsson ED, Palmqvist S (2017) De Montreal Cognitive Assessment: normatieve gegevens van een groot Zweeds populatie-gebaseerd cohort. J Alzheimer Dis 59, 893-901. |
| [41] | Ciesielska N, Sokolowski R, Mazur E, Podhorecka M, Polak-Szabela A, Kedziora-Kornatowska K (2016) Is de Montreal Cognitive Assessment (MoCA)-test beter geschikt dan het Mini-Mental State Examination (MMSE) bij de detectie van milde cognitieve stoornissen (MCI) bij mensen ouder dan 60 jaar? Meta-analyse. Psychiater Pol 50, 1039-1052. |
| [42] | Giebel CM, Challis D (2017) Gevoeligheid van het Mini-Mental State Examination, Montreal Cognitieve beoordeling en het cognitieve onderzoek van Addenbrooke III voor alledaagse activiteiten stoornissen bij dementie: een verkennend onderzoek. Int J Geriatr Psychiatry 32, 1085-1093. |
| [43] | Kopecek M, Bezdicek O, Sulc Z, Lukavsky. J, Stepankova H (2017) Montreal Cognitive Assessment en Mini-Mental State Examination betrouwbare veranderingsindices bij gezonde oudere volwassenen. Int J Geriatr Psychiatrie 32, 868-875. |
| [44] | Roalf DR, Moore TM, Mechanic-Hamilton D, Wolk DA, Arnold SE, Weintraub DA, Moberg PJ (2017) Overbrugging van cognitieve screeningtests bij neurologische aandoeningen: een zebrapad tussen de korte Montreal Cognitive Assessment en Mini-Mental State Examination. Alzheimer Dement 13, 947-952. |
| [45] | Solomon TM, deBros GB, Budson AE, Mirkovic N, Murphy CA, Solomon PR (2014) Correlationele analyse van 5 veelgebruikte metingen van cognitief functioneren en mentale status: een update. Am J Alzheimer's Dis Other Demen 29, 718-722. |
| [46] | Mellor D, Lewis M, McCabe M, Byrne L, Wang T, Wang. J, Zhu M, Cheng Y, Yang C, Dong S, Xiao S (2016) Bepalen van geschikte screeningsinstrumenten en afkappunten voor cognitieve stoornissen bij een oudere Chinese steekproef. Psychol Evaluatie 28, 1345-1353. |
| [47] | Snowdon A, Hussein A, Kent R, Pino L, Hachinski V (2015) Vergelijking van een elektronische en papieren Montreal Cognitive Assessment Tool. Alzheimer Dis Assoc-stoornis 29, 325-329. |
| [48] | Eisdorfer C, Cohen D, Paveza GJ, Ashford JW, Luchins DJ, Gorelick PB, Hirschman RS, Freels SA, Levy PS, Semla TP et al. (1992) Een empirische evaluatie van de Global Deterioration Scale voor enscenering Ziekte van Alzheimer. Am J Psychiatrie 149, 190–194. |
| [49] | Butler SM, Ashford JW, Snowdon DA (1996) Leeftijd, opleiding en veranderingen in de Mini-Mental State Exam-scores van oudere vrouwen: bevindingen uit de Nun Study. J Am Geriatr Soc 44, 675-681. |
| [50] | Schmitt FA, Davis DG, Wekstein DR, Smith CD, Ashford JW, Markesbery WR (2000) "Preclinical" AD revisited: neuropathologie van cognitief normale oudere volwassenen. Neurologie 55, 370-376. |
| [51] | Schmitt FA, Mendiondo MS, Kryscio RJ, Ashford JW (2006) Een korte Alzheimer scherm voor de klinische praktijk. Res Pract Alzheimer Dis 11, 1–4. |
Trefwoorden: ziekte van Alzheimer, continue prestatietaak, dementie, ouderen, geheugen, milde cognitieve stoornis, screening
Gerelateerde Links:
New Test met vingertikken - Psychomotorische snelheidstest
Het MIND-dieet: Brain Eten voor een Brain Booster
